le forze di Van der Waals si dividono in tre tipi:
_ le forze di London sono le più deboli, questa forza consiste in dipoli temporanei e ciò è dovuto al rapidissimo e disordinato moto degli elettroni attorno al nucleo.
_ l'iterazione dipolo/dipolo sono delle forze che si creano tramite dei deboli campi elettrici che fanno sentire la loro influenza a molecole polari vicine, attirandole e orientandole.
_ il legame idrogeno è la più forte delle forze di Van der Waals questa forza viene esercitata su atomi piccoli e molto elettronegativi (F, O, N) e l'idrogeno.
domenica 6 gennaio 2013
legami covalente, ionico e metallico
i legami più conosciuti sono di tre tipi covalente, ionico e metallico.
il legame covalente nasce dalla condivisione di una o più coppia di elettroni da parte di due atomi. in tal modo gli atomi riescono a realizzare l'ottetto di stabilità.
il legame covalente può essere definito puro o covalente polare:
_ il legame covalente puro o omopolare è il legame che si stabilisce tra due atomi uguali e con differenza di elettronegatività pari a 0.
_ il legame covalente polare è il legame che si stabilisce tra due atomi diversi e con differenza di elettronegatività tra 0 e 1,9.
il legame di tipo ionico si stabilisce quando la differenza di elettronegatività è maggiore di 1,9 e in tal modo si formano due ioni di segno opposto tra i quali c'è una reciproca forza di attrazione e viene a formarsi un reticolo cristallino.
il legame metallico e un legame che interessa solo ioni positivi formando delle strutture cristalline di due tipi: cubica a corpo centrato o cubica a facce centrate. la teoria più moderna riguardante il legame metallico è la teoria delle bande.
il legame covalente nasce dalla condivisione di una o più coppia di elettroni da parte di due atomi. in tal modo gli atomi riescono a realizzare l'ottetto di stabilità.
il legame covalente può essere definito puro o covalente polare:
_ il legame covalente puro o omopolare è il legame che si stabilisce tra due atomi uguali e con differenza di elettronegatività pari a 0.
_ il legame covalente polare è il legame che si stabilisce tra due atomi diversi e con differenza di elettronegatività tra 0 e 1,9.
il legame di tipo ionico si stabilisce quando la differenza di elettronegatività è maggiore di 1,9 e in tal modo si formano due ioni di segno opposto tra i quali c'è una reciproca forza di attrazione e viene a formarsi un reticolo cristallino.
il legame metallico e un legame che interessa solo ioni positivi formando delle strutture cristalline di due tipi: cubica a corpo centrato o cubica a facce centrate. la teoria più moderna riguardante il legame metallico è la teoria delle bande.
legami ed elettronegatività
gli atomi tendono a legarsi tra loro spontaneamente e cercando di raggiungere l'ottetto di stabilità.
l'energia di legame e la quantità di energia necessaria a rompere tale legame o anche l'energia sviluppata quando si forma tale legame viene misurata in kJ/mol.
l'elettronegatività è la capacità che un atomo possiede di attrarre verso di sé la coppia di elettroni messa in gioco nel legame chimico i valori dell'elettronegatività sono inferiori, nella tavola periodica, in basso a sinistra e crescono andando verso l'alto e verso destra.
tavola peridica
la tavola periodica che viene utilizzata ancora oggi da tutti è quella ideata da Mendeleev e basata sul peso atomico.
la tavola periodica è basata sulla lettura di gruppi e periodi
_ i periodi sono le righe orizzontali in cui sono presenti gli elementi essi si susseguono per numero atomico, nel senso che ogni elemento ha nel suo nucleo un protone in più dell'elemento che lo precede.
_ i gruppi, invece, sono le colonne verticali in cui gli elementi che le compongono manifestano proprietà simili, per esempio configurazione elettronica.
la tavola periodica è basata sulla lettura di gruppi e periodi
_ i periodi sono le righe orizzontali in cui sono presenti gli elementi essi si susseguono per numero atomico, nel senso che ogni elemento ha nel suo nucleo un protone in più dell'elemento che lo precede.
_ i gruppi, invece, sono le colonne verticali in cui gli elementi che le compongono manifestano proprietà simili, per esempio configurazione elettronica.
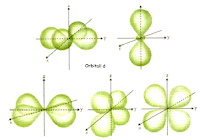
orbitali p, d, f
l'orbitale p ha 3 orientamenti diversi nello spazio e precisamente lungo i tre assi cartesiani x, y e z.
il sottolivello p è perciò formato da tre orbitali px, py e pz ed può essere occupato al massimo da 6 elettroni.
l'orbitale d ha 5 diversi orientamenti nello spazio.
il sottolivello d è può essere occupato al massimo da 10 elettroni.
l'orbitale f ha 7 orientamenti diversi nello spazio.
il sottolivello f può contenere al massimo 14 elettroni.
il sottolivello p è perciò formato da tre orbitali px, py e pz ed può essere occupato al massimo da 6 elettroni.
l'orbitale d ha 5 diversi orientamenti nello spazio.
il sottolivello d è può essere occupato al massimo da 10 elettroni.
l'orbitale f ha 7 orientamenti diversi nello spazio.
il sottolivello f può contenere al massimo 14 elettroni.
venerdì 4 gennaio 2013
numeri quantici e orbitali s
negli atomi la parte in cui c'è maggiore possibilità di trovare gli elettroni e definita orbitale; la probabilità di trovare elettroni in questa zona è molto alta almeno del 90%.
per definire la forma , dimensioni e orientamento di un orbitale occorrono tre numeri quantici:
_il numero quantico principale n corrisponde al livello energetico che un elettrone può occupare.
il numero n può assumere tutti i valori compresi tra 1 e 7; le dimensioni dell'orbitale dipendono strettamente da n al crescere si n crescono anche le dimensioni dell'orbitale.
_ il numero quantico secondario l (detto anche numero quantico angolare questo numero quantico definisce la forma dell'orbitale. gli elettroni com l = 0 vengono detti elettroni s; gli elettroni con l = 1 vengono detti p; gli elettroni con l = 2 vengono detti p; ed infine quelli con l = 3 vengono detti f.
_ il numero quantico magnetico m indica il numero di orientamenti di un dato orbitale nello spazio.
_ il numero quantico di spin, Ms indica il verso del moto reattori dell'elettrone.
l'orbitale s ha forma sferica e gli orbitali 1s 2s 3s differiscono tra loro
solo per il raggio; questo orbitale può essere occupato massimo da due elettroni.
per definire la forma , dimensioni e orientamento di un orbitale occorrono tre numeri quantici:
_il numero quantico principale n corrisponde al livello energetico che un elettrone può occupare.
il numero n può assumere tutti i valori compresi tra 1 e 7; le dimensioni dell'orbitale dipendono strettamente da n al crescere si n crescono anche le dimensioni dell'orbitale.
_ il numero quantico secondario l (detto anche numero quantico angolare questo numero quantico definisce la forma dell'orbitale. gli elettroni com l = 0 vengono detti elettroni s; gli elettroni con l = 1 vengono detti p; gli elettroni con l = 2 vengono detti p; ed infine quelli con l = 3 vengono detti f.
_ il numero quantico magnetico m indica il numero di orientamenti di un dato orbitale nello spazio.
_ il numero quantico di spin, Ms indica il verso del moto reattori dell'elettrone.
l'orbitale s ha forma sferica e gli orbitali 1s 2s 3s differiscono tra loro
solo per il raggio; questo orbitale può essere occupato massimo da due elettroni.
ioni e energia di ionizzazione
dopo le scoperte delle particelle subatomiche (protone, elettrone e neutrone) si è capito che l'atomo era qualcosa di molto complesso e con molte proprietà un esempio è che questi atomi possono acquistare o perdere elettroni per diventare ioni.
questo fenomeno viene definito in modo diverso se si acquista o perde un elettrone:
_ quando un atomo, elettricamente neutro, perde uno o più elettroni, e ha delle cariche positive in eccedenza esso diventa uno ione positivo.
_ quando un atomo, elettricamente neutro, acquista uno o più elettroni, e ha delle cariche negative in eccedenza esso diventa uno ione negativo.
per strappare ha un atomo un elettrone, nel suo stato gassoso, bisogna fornire una quantità di energia ben definita chiamata energia di ionizzazione.
questo fenomeno viene definito in modo diverso se si acquista o perde un elettrone:
_ quando un atomo, elettricamente neutro, perde uno o più elettroni, e ha delle cariche positive in eccedenza esso diventa uno ione positivo.
_ quando un atomo, elettricamente neutro, acquista uno o più elettroni, e ha delle cariche negative in eccedenza esso diventa uno ione negativo.
per strappare ha un atomo un elettrone, nel suo stato gassoso, bisogna fornire una quantità di energia ben definita chiamata energia di ionizzazione.
giovedì 3 gennaio 2013
modello atomico di Bohr
un nuovo modello atomico è creato da Bohr in cui ci sono vari livelli energetici e gli elettroni passano da un livello ad un altro secondo il livello energetico richiesto. questo modello è rappresentato da orbite circolari concentriche attorno al nucleo.
la luce
alla fine del XIX secolo la luce e ogni altro tipo di radiazione veniva considerata come un emissione continua, nel 1900 Planck non avanzò un'ipotesi secondo la quale la luce viene emessa per piccolissime quantità dette quanti.
nel 1905 Einstein applicò l'ipotesi di Planck per spiegare l'effetto fotoelettrico; alle particelle di luce venne dato il nome di fotoni
radioattività
una scoperta quasi casuale da un importante aiuto agli studi sulla struttura dell'atomo. Becquerel scopre che in alcuni elementi è presente il fenomeno della radioattività spontanea. la radioattività consiste nella capacità di questi elementi di emettere radiazioni di tre tipi:
_ le radiazioni α sono particelle di elio che recano con sé due cariche positive, esse tra i tre tipi di particelle sono le meno penetranti.
_ le radiazioni β sono particelle che recano con sé una carica negativa, sono costituite, infatti, da elettroni molto veloci. sono più penetranti delle particelle α.
_ le radiazioni γ sono prive di carica elettrica hanno natura ondulatoria come la luce, della quale posseggono molte altre proprietà. il loro potere penetrante è molto elevato.
_ le radiazioni α sono particelle di elio che recano con sé due cariche positive, esse tra i tre tipi di particelle sono le meno penetranti.
_ le radiazioni β sono particelle che recano con sé una carica negativa, sono costituite, infatti, da elettroni molto veloci. sono più penetranti delle particelle α.
_ le radiazioni γ sono prive di carica elettrica hanno natura ondulatoria come la luce, della quale posseggono molte altre proprietà. il loro potere penetrante è molto elevato.
mercoledì 2 gennaio 2013
isotopi
spesso troviamo che in alcuni atomi il numero di protoni è uguale ma abbiamo un differente numero di neutroni, essi sono gli isotopi. questi possono essere stabili o instabili quindi radioattivi.
Nella tavola periodica il valore della massa atomica è il risultato della media ponderata tra i valori delle masse atomiche dei vari isotopi.
Nella tavola periodica il valore della massa atomica è il risultato della media ponderata tra i valori delle masse atomiche dei vari isotopi.
Iscriviti a:
Post (Atom)